Klinik für Allgemein- und Visceralchirugie
Allgemein- und Visceralchirurgie
Sehr geehrte Damen und Herren,
liebe Patientinnen und Patienten,
die Klinik für Allgemein- und Visceralchirurgie verfügt über 70 Betten sowie 16 Betten auf der chirurgischen, interdisziplinär genutzten Intensivstation und weitere 10 Betten auf der anästhesiologischen Intensivstation. Jährlich behandeln wir rund 3.500 Patienten stationär, darüber hinaus verfügen wir über ein gut organisiertes Zentrum für ambulante Operationen. Insgesamt werden ca. 5.000 operative Eingriffe pro Jahr durchgeführt.
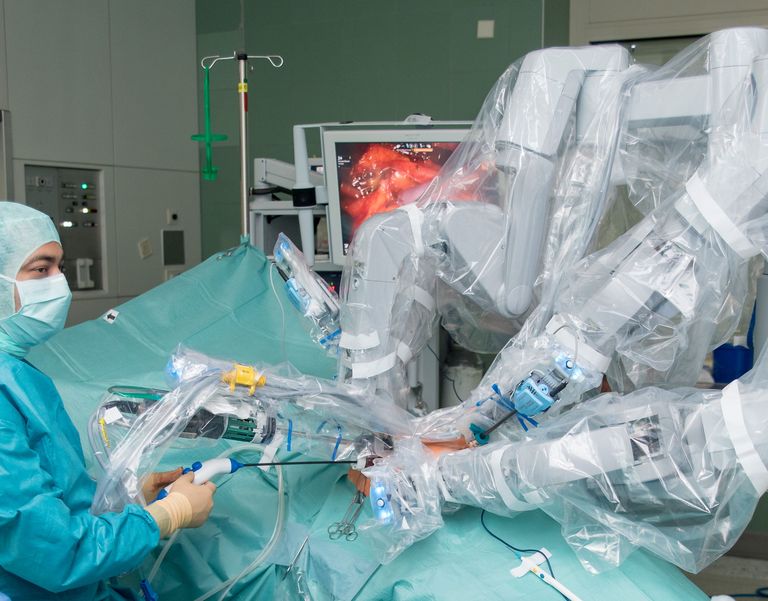
Als Maximalversorger decken wir das gesamte Operationsspektrum der Allgemein- und Visceralchirurgie ab. Therapieangebote nach dem neuesten Stand der Wissenschaft, eine hochmoderne technische Ausstattung sowie erfahrene Ärzte und das engagierte Pflegeteam tragen dazu bei, dass Sie während Ihres Klinikaufenthaltes optimal betreut werden.
Neben der medizinischen Versorgung auf höchstem Niveau sind uns persönliche Zuwendung und Fürsorge ein großes Anliegen. Wir möchten Ihnen den Klinikaufenthalt so angenehm wie möglich gestalten.
Über Fragen freuen wir uns, rufen Sie einfach an oder schicken Sie uns eine E-Mail.